Иммунизация и определение титра полученных антител
|


Рисунок 17. А. ДСН-электрофорез фракций
1 – очищенный АТФ-чувствительный К+-транспортирующий белок с м.м. 55 кДа, 2 – молекулярные стандарты массы белков, 3 – суммарный белок МХ. Б. Вестерн-блот анализ: 1 – очищенный АТФ-чувствительный К+-транспортирующий белок с м.м. 55 кДа, 2 – суммарный белок МХ.
Показано, что полученные в работе антитела специфически связываются только с белком с м.м. 55 кДа, и не вязываются ни с одним из массы белков, находящихся в МХ (Рис.19). Таким образом, в работе были получены специфические поликлональные антитела на белок с м.м. 55 кДа.
Этим же методом было установлено, что поликлональные антитела на исследуемый белок-канал, полученный из МХ печени крысы, не взаимодействует с той же концентрацией аналогичного белка с м.м. 55 кДа, выделенного тем же методом из МХ сердца крысы. Данный факт указывает на то, что исследуемый белок с м.м. 55 кДа тканеспецифичен.
Выделение иммуноглобулинов G (IgG) из антисыворотки и проведение ингибиторного анализа
Полученные антитела к АТФ-чувствительному К+-транспортирующему белку с м.м. 55 кДа, выделенному из МХ печени крысы, использовали в качестве ингибитора АТФ-зависимого транспорта ионов калия в МХ печени крысы. Для этого, полученные очищенные и концентрированные антитела (иммуноглобулины G (IgG)) кроликов (см. «Материалы и методы»). Контролем служили очищенные IgG сыворотки крови Интактных (неиммунизированных) кроликов. Кроме того, в качестве контроля использовались антитела к белку с м.м. 55 кДа, подвергнутые кипячению в течение 5 минут. Ранее было показано, что такая процедура ведет к потере белком активности. IgG контрольных животных получали тем же способом, что и IgG рабочей сыворотки. В ходе выделения и очистки IgG титр антител и сродство к белку-каналу с м.м. 55 кДа существенно не изменяется. Степень чистоты выделенных из сыворотки IgG определяли методом ДДС-ПААГ электрофореза [Laemmli, 1979] (см. «Материалы и методы»).
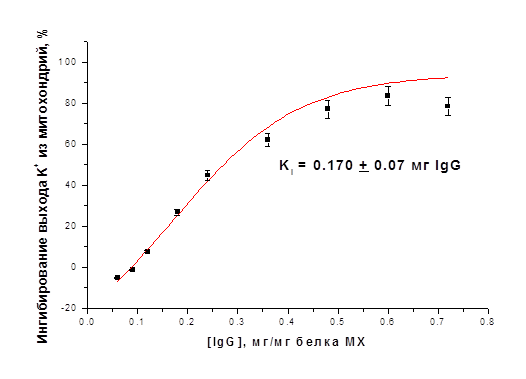
Очищенные фракции IgG, выделенные из иммунизированных и интактных животных, использовали для ингибирования АТФ-зависимого выхода ионов К+ из МХ в присутствии ДНФ, отражающего работу митоКАТФ, и энергозависимого входа ионов К+ в МХ. Все эксперименты проводились при термостатировании (26°С) и постоянном перемешивании. После 1.5-2 минут преинкубации антител с митохондриями транспорт ионов К+ индуцировали ДНФ (при исследовании выхода К+ из МХ К+-селективным электродом) или субстратом дыхания (при определении энергозависимого входа К+ в МХ). Для повышения эффективности взаимодействия IgG с внутренней мембраной МХ создавались гипотонические условия. На рисунке 6 представлена концентрационная зависимость степени ингибирования выхода ионов К+ из МХ печени крысы в присутствии разобщителя (ДНФ). Ингибирующий эффект антител наблюдается только в случае добавления в среду инкубации МХ очищенных интактных IgG к АТФ-зависимому К+-транспортирующему белку с м.м. 55 кДа, выделенному из печени крысы. Степень ингибирования зависела от концентрации IgG и времени преинкубации.