Системы транспорта калия в митохондриях
Что касается специфических белков, следует отметить, что в лаборатории Мироновой в 1981 г. методом водно-этанольной экстракции из МХ сердца быка был выделен и очищен белок с м.м. 55 кДа, который при реконструкции в бислойные липидные мембраны (БЛМ) образовывал К+-селективные каналы проводимости [Миронова и др., 1981], которые, как было показано позднее, ингибируются физиологической концентрацией АТФ и глибенкламидом, и относятся к семейству АТФ-чувствительных калиевых каналов [Миронова и др., 1996 (I); Mironova et al., 1999]. Структура митохондриального КАТФ канала не определена [Paucek et al., 1992].
Диван с соавторами, используя детергент Тритон Х-100, из МХ мембраны печени крыс выделили белок с м.м. 53 кДа [Diwan et al., 1988]. Реконструировав его в липосомы, авторы показали, что этот белок также обладает свойствами, характерными для К+ унипортера.
Известно, что в МХ помимо системы электрогеннного входа К+ существует система электронейтрального выхода К+ в обмен на Н+ [Garlid and Paucek, 2003]. При этом внешняя МХ мембрана не препятствует дальнейшему обмену небольшими ионами с цитоплазмой.
Система электрогенного входа калия и электронейтрального К+/Н+-обменника образуют К+ цикл МХ (Рис.1).
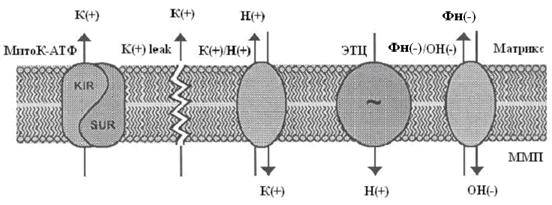
Рис. 1. МХ калиевый цикл по Garlid and Paucek, 2003.
ЭТЦ – электрон-транспортная цепь; ММП – межмембранное пространство; Фн – неорганический фосфат.
Электрогенный выброс протонов электрон-транспортной системой генерирует мембранный потенциал, который, в свою очередь, стимулирует диффузию К+ в матрикс МХ («утечка калия» или К+ leak) и вход иона, опосредованный неким специфическим калиевым каналом. Такой обмен Н+ на К+ подщелачивает матрикс, вызывая вход фосфата по электронейтральному Фн-Н+ симпортеру (Фн – неорганический фосфат) (Рис.1).
Вход К+ сопровождается накоплением осмотически облигатной воды, что проявляется в набухании МХ. Излишнее их набухание может угрожать целостности этих органелл, следовательно, избыток К+ необходимо удалять. Эту функцию выполняет белок с м.м. 82 кДа - К+/Н+-антипортер [Brierley G., 1976; Garlid K., et al., 1980; 1988]. Следует отметить, что вход К+ путем диффузии слишком мал, чтобы существенно влиять на изменение объема матрикса МХ. Интенсивный вход калия в МХ обеспечивается специфическими белками, осуществляющими электрофоретический вход К+ в МХ [Mironova G., 1981; Diwan J., et al., 1988; Paucek et al., 1992].
Физиологическое значение транспорта калия в МХ
Предполагается, что основное физиологическое значение систем транспорта К+ в МХ связано с регуляцией объема МХ матрикса. Объем МХ определяется калиевыми токами через внутреннюю мембрану. Когда вход и выход К+ находятся в равновесии, калиевые потоки определяются электронейтральным током анионов и осмотически облигатной воды [Garlid, 1988]. Так как концентрация ионов калия в матриксе и в цитоплазме практически одинаковая, транспорт калия мало влияет на матриксную концентрацию калия, но может иметь большое влияние на объем МХ. Небольшое нескомпенсированное увеличение входа К+ в МХ может удваивать их объем в течение 1-2 минут [Garlid, 1979]. В свою очередь, увеличение матриксного объема стимулирует активность дыхательной цепи, что было показано на МХ сердца и печени [Nichols and Lindberg, 1972; Halestrap, 1989]. Окисление жирных кислот также чувствительно к изменению объема матрикса [Halestrap, 1987].